醫用觀片燈生產廠家兆豐光電5月24日訊
為深入推進審評審批制度改革,鼓勵醫療器械創新,深化供給側結構性改革和“放管服”改革要求,激勵產業創新高質量發展,為進一步做好程序規定的創新醫療器械申報資料編寫和技術審查工作,對程序進行研究修改,國家藥監局于2018年發布了新修訂的《創新醫療器械特別審查程序》和《創新醫療器械特別審查申報資料編寫指南》,施行至今。
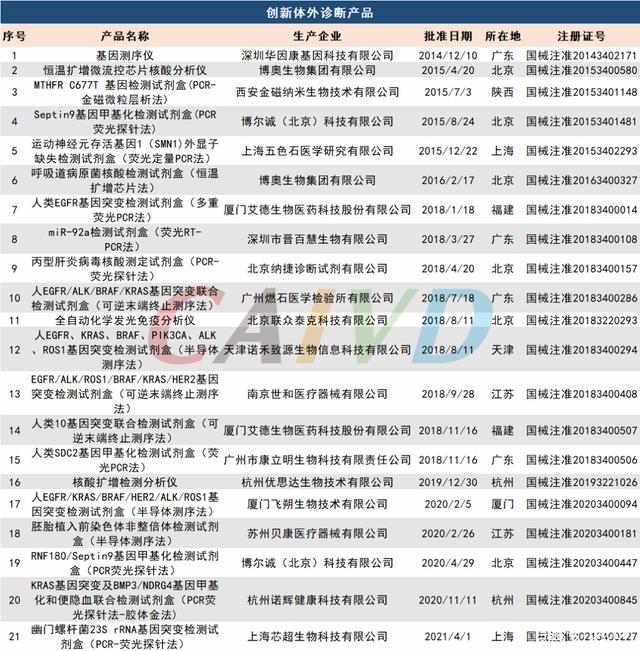
自2014起,該程序的實施對醫療器械研發創新、新技術推廣應用、產業高質量發展起到了積極推動作用。經統計,體外診斷行業已批準21個創新產品上市,這些產品創新性強、技術含量高、臨床需求迫切,填補了相關領域的空白,更好的滿足了人民群眾的健康需求。
這些企業包括(按時間先后)
華因康基因、博奧生物、金磁納米生物、博爾誠、五色石醫學、艾德生物、晉百慧生物、納捷診斷、燃石醫學、聯眾泰克、諾禾致源、世和醫療、康立明生物、優思達生物、飛朔生物、貝康醫療、諾輝健康、芯超生物。
“創新是體外診斷人進步的靈魂,也是體外診斷行業發展的不竭動力”,堅信在政策與環境的扶持下,體外診斷創新產品將越來越多!
免責聲明:本站部份內容系轉載,不代表本網站贊同其觀點;如涉及內容、版權等問題,請在30日內聯系,我們將在第一時間刪除內容!